Comment respirer sur Mars?
La photosynthèse
Une atmosphère vivable à l’Homme consiste en une présence d’eau sous ces trois états (liquide, solide et gazeux soit eau liquide, glace et vapeur d’eau) et de différents gaz en faible pourcentages (O2, CO2, N… ) comme il existe sur la Terre.
Après différentes missions réalisées autour et sur Mars, on a pu apprendre que la planète Rouge a son atmosphère composée majoritairement de CO2 (95%) et ne possède de l’eau que sous forme de blocs de glace. Cela signifie donc qu’elle n’est pas vivable pour l’homme pour le moment.
Pour cela, on pourrait utiliser le processus de photosynthèse réalisée par des végétaux, micro-organismes et bactéries comme les phytoplanctons, micro-algues et cyanobactéries rendu possible grâce à la présence d’eau liquide.
La photosynthèse est une réaction chimique produite par les végétaux en absorbant de l’énergie lumineuse et produisant O2.
Les différents micro-organismes exposés précédemment sont les premiers organismes apparus sur la Terre sous des conditions arides (uniquement de l’eau liquide) et sont donc à l’origine de la chaîne alimentaire marine. Outre les végétaux chlorophylliens, les micro-organismes produisent la moitié de la quantité d’O2 nécessaire à la vie grâce au procédé de photosynthèse, tout en absorbant du CO2, N et PO43-. En effet, les végétaux ont besoin d’éléments minéraux comme l’O2 pour produire leur propre matière organique.
Ils sont donc indispensables à la vie et permettrait par leur développement la mise en place d’une atmosphère vivable pour l’Homme sur la surface martienne.
Enfin avec le réchauffement de Mars apportant la présence d’eau liquide et la transformation de l’atmosphère martienne en une atmosphère vivable, l’accueil de la vie pour de nombreux organismes, puis l’envoi d’hommes et leur vie sur le sol martien pourrait être envisagé.
TP - La photosynthèse
Nous avons effectué un TP, ayant pour but de mettre en évidence le processus de photosynthèse. En premier lieu, nous avons placé des algues (élodées) sous un entonnoir, lui-même renversé et immergé totalement dans l’eau d’un cristallisoir. Puis nous avons ajouté un tube à essai renversé sur l’entonnoir, lui-même rempli d’eau. En éclairant les élodées avec un projecteur puissant, nous avons ainsi réuni les conditions nécessaires à la mise en route du phénomène de photosynthèse. L’expérience a été réalisée deux fois avec des conditions expérimentales différentes. Dans le premier cristallisoir, l’eau était de l’eau déminéralisée, c’est-à-dire de l’eau à l’état pur, dépourvue de minéraux. Dans le deuxième cristallisoir, l’eau que nous avons placée était de l’eau du robinet, relativement chargée en minéraux.
Les quantités d’élodée dans les deux cristallisoirs étaient relativement équivalentes, mais aucune mesure n’a été effectuée. Un protocole plus précis aurait imposé de peser les deux échantillons d’élodée afin de s’assurer que l’eau était le seul paramètre changé entre les deux cristallisoirs.
Au bout d’environ 5 heures sous la lumière du projecteur, les résultats étaient satisfaisants. On a remarqué que les élodées dans l’eau du robinet ont produit quelques centimètres de gaz dans le tube à essai tandis que les élodées dans l’eau déminéralisée en ont produit quelques millimètres. Théoriquement, en l’absence de minéraux et donc de CO2, le deuxième échantillon n’aurait pas dû produire de dioxygène, mais il existe une marge d’erreur à l’origine de cette différence. On pense notamment que les élodées, prélevées d’une eau non déminéralisée, transportaient quelques minéraux ayant donc mené à la production d’une petite quantité de dioxygène.
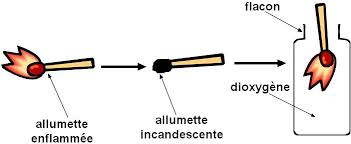
Grâce au test à l’amulette, on a pu mettre en évidence le dioxygène. Le principe consiste à allumer une amulette puis l’éteindre afin qu’elle garde un bout incandescent. Au contact avec le gaz à mettre en évidence, le bout incandescent de l’amulette s’est ravivé.
Ainsi, le dioxygène produit par le processus de photosynthèse a été mis en évidence.
Bien que léger, le ravivement de l’allumette incandescente met en évidence le dioxygène
TP - L'électrolyse de l'eau
L’électrolyse de l’eau est un phénomène artificiel, qui utilise l’énergie électrique afin de séparer les molécules d’eau en dioxygène et en dihydrogène.
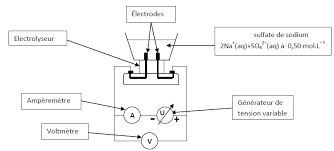
Au début de l’expérience, nous avons préparé l’électrolyseur avec une solution de sodium. Nous avons ensuite branché à l’électrolyseur un générateur à tension variable. Puis nous avons ajouté un ampèremètre et un voltmètre aux bornes de l’électrolyseur. La tension de départ était de U= 0,0 V. Nous avons augmenté cette valeur petit à petit.
Nous avons utilisé une solution aqueuse de sulfate de sodium car elle contient des ions sodium Na+(aq) et sulfate SO42- (aq) qui assurent la conduction du courant électrique dans la solution de l’électrolyseur. L’eau pure n’est pas conductrice.
L’électrolyseur contient deux bornes: la borne + (la cathode) et la borne – (l’anode). Au niveau des deux bornes, les équations des réactions sont les suivantes:
A l’anode (lieu de l’oxydation) : 2 H2O (l) ——> O2(g) + 4 H+ (aq) + 4 e-
A la cathode (lieu de la réduction) : 2 H2O (l) + 2 e- ——> H2 (g) + 2OH- (aq)
Dans cette vidéo, on peut observer l’oxydoréduction liée à l’électrolyse de l’eau accélérée. La durée de la réaction, en bas à gauche de l’écran, est en réalité d’environ 40 minutes. On remarque que la production de dioxygène (à gauche) est deux fois plus conséquente que la production de dihydrogène (à droite). Cela est simplement dû à la structure des molécules d’eau, composées de deux atome d’hydrogène (H) et d’un atome d’oxygène (O) soit deux fois plus d’atomes d’hydrogène que d’atomes d’oxygène.
Nous avons ensuite mis en évidence le dioxygène grâce au test de l’allumette (voir TP photosynthèse)
Le dihydrogène, quant à lui, a été mis en évidence par une allumette. La flamme de cette allumette, par contact avec le dihydrogène, crée une détonation.
Dans cette vidéo, on peut entendre la légère détonation qui prouve la présence de dihydrogène
Sur Mars, il est donc possible de créer de l’oxygène à partir d’eau à l’état liquide. En revanche, cela nécessite de l’énergie électrique en conséquence, ce qui renvoie au problème de production d’énergie électrique sur Mars. De plus, il est possible de récupérer le dihydrogène produit par l’électrolyse pour faire fonctionner des moteurs à hydrogène. En revanche, ces moteurs, en plus du dihydrogène, nécessitent du dioxygène. Or, c’est en produisant le dioxygène qu’il y a un apport de dihydrogène. C’est donc seulement en cas de surplus de dioxygène que le dihydrogène pourrait être utilisé dans ces moteurs.
Site créé par De Bazelaire Simon, Ostheimer Kléa, Rezaoui Samy, et Scherbeck Louise dans le cadre des TPE année 2018/2019